Оказалось, что они взаимодействуют принципиально иным образом в сравнении с классическими змеиными трехпетельными α-нейротоксинами. Учёные подробно описали открытый новый тип взаимодействия в публикации в журнале Communications Biology (из группы Nature). Исследование проходило при поддержке гранта РНФ (проект № 19-74-20163).
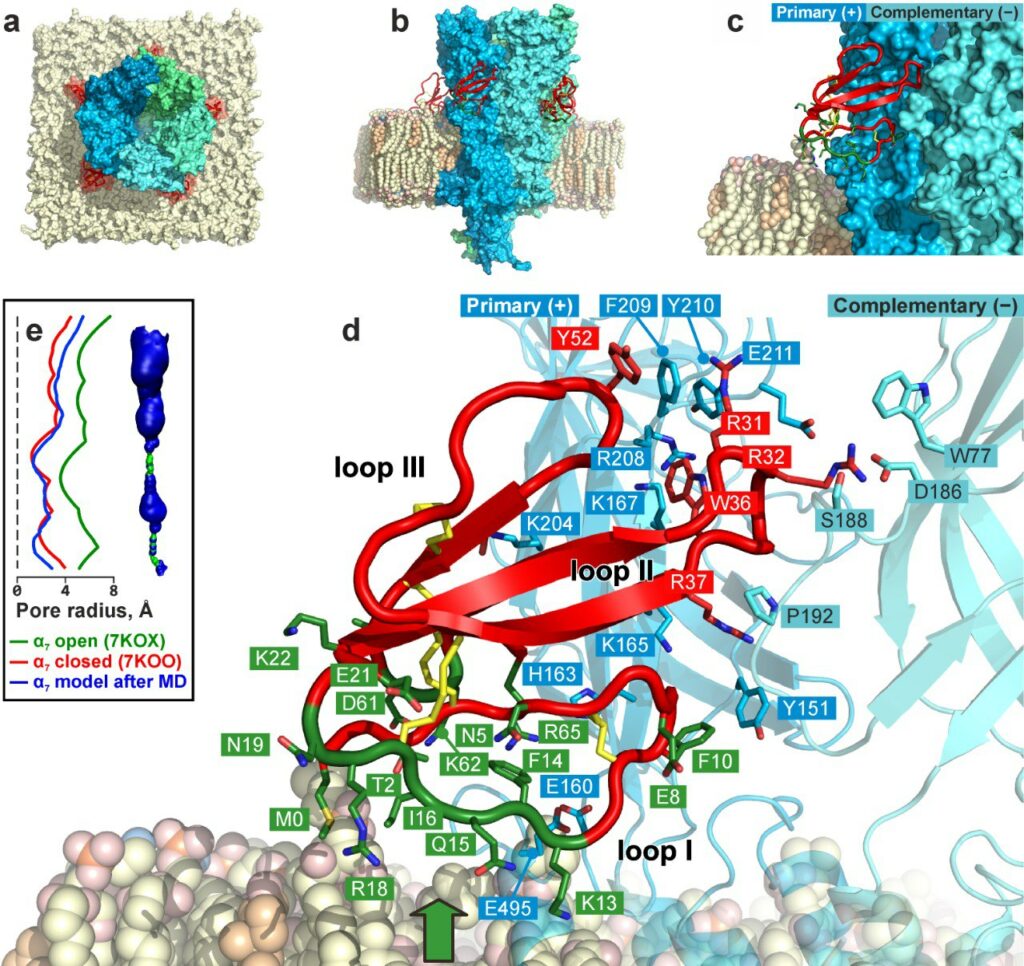
Никотиновый ацетилхолиновый рецептор α7-типа (α7-nAChR), представленный в нервной и иммунной системах и эпителии, является перспективной терапевтической мишенью для лечения когнитивных дисфункций и рака. Слабый токсин из яда кобры Naja kaouthia (WTX) относится к классу «необычных» трехпетельных α-нейротоксинов змей, ингибирующих α7-nAChR с низкой аффинностью. Данных о характере взаимодействия необычных α-нейротоксинов с α7-nAChR до настоящего времени не было.
Коллектив преподавателей магистерской программы биологического факультета МГУ «Структурная биология и биотехнология» в сотрудничестве с исследователями из ИБХ РАН, НИЦ «Курчатовский Институт» и Института биомедицинской химии показали применимость криоэлектронной микроскопии (крио-ЭМ) для изучения взаимодействия внеклеточного лиганд-связывающего домена α7-nAChR (α7-ECD) с его лигандами, несмотря на близость размера комплекса к нижней границе размеров биомолекул, доступных для исследования этим методом структурной биологии.
Крио-ЭМ структура комплекса α7-ECD/WTX вместе с данными ЯМР-спектроскопии о мембрано-активном сайте в молекуле WTX и данными сайт-направленного мутагенеза позволили реконструировать структуру полноразмерного рецептора α7-nAChR в комплексе с токсином в мембранном окружении.
«Показано, что WTX взаимодействует со входом в ортостерический сайт, расположенным на интерфейсе соседних субъединиц рецептора, и одновременно образует многочисленные контакты с поверхностью мембраны, окружающей рецептор, — поясняет профессор биологического факультета МГУ, руководитель магистерской программы «Структурная биология и биотехнология» Екатерина Люкманова. — Тип взаимодействия WTX с α7-nAChR существенно отличается от описанных ранее для длинных и коротких трехпетельных α-нейротоксинов, не контактирующих с мембраной».
Исследование показывает важную роль мембраны во взаимодействии необычных α-нейротоксинов с никотиновыми рецепторами.