Текст: Третьяков Артемий
Что может делать?
С помощью конфокального микроскопа можно получить несколько изображений виртуальных срезов клетки, или же собранную из них трехмерную модель. Такие возможности дает лазер, луч которого можно фокусировать в любой точке клетки. Для получения изображения объект должен быть флуоресцентно активен, то есть при попадании луча лазера он (а точнее, определенные молекулы в его составе) должен испускать свет с большей длиной волны, чем попадающий на него, который и улавливается микроскопом. Изображение строится как раз на основе этой флуоресценции.
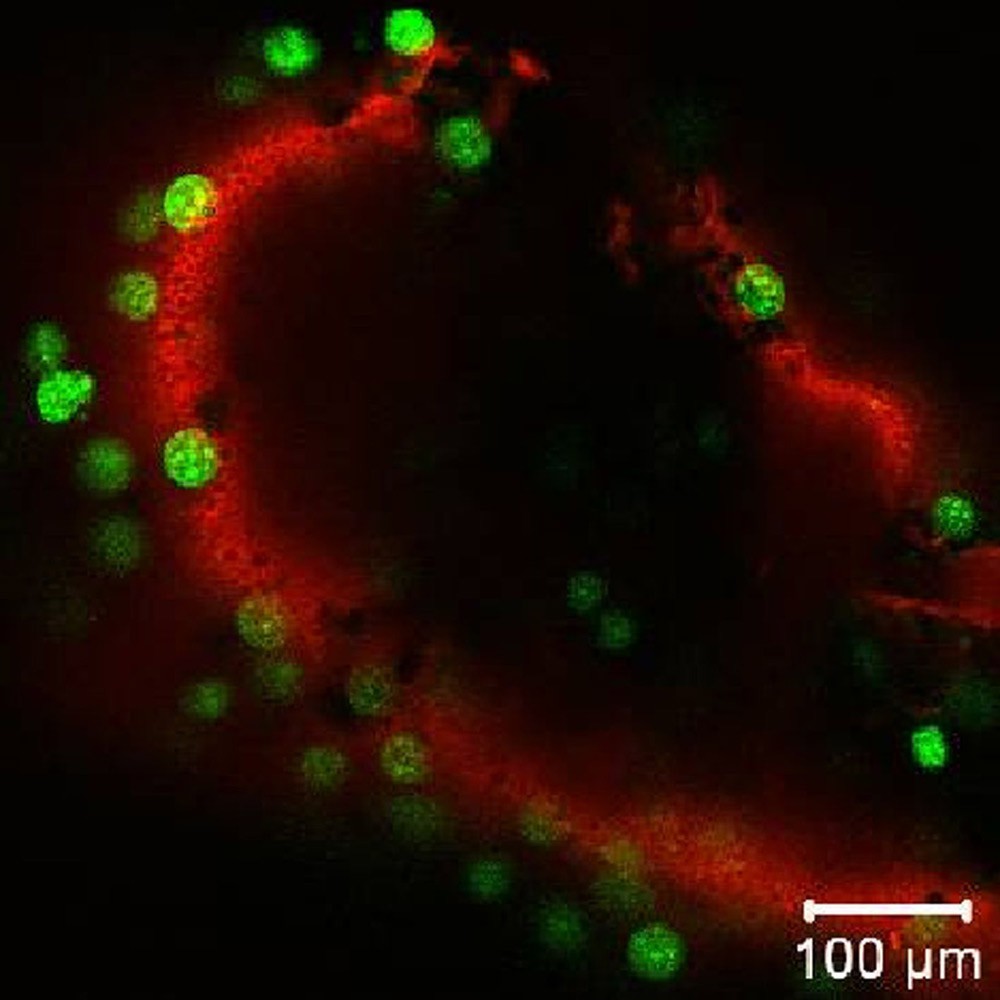
Фото: Клетки костного мозга на матриксе из регенерированного фиброина шелка. Ядра выявлены SYBR Green, показаны зеленым. Gr-1 (granulocyte differentiation antigen 1) выявлен антителами к Gr-1, конъюгированными с PE, показан красным. Изображение получено с использованием конфокальной системы Nikon A1 в рамках совместной работы д.б.н. Недоспасова С.А., к.б.н. Друцкой М.С. и к.б.н. Мойсеновича М.М.
Как работает?
«Современный уровень развития фундаментальных и прикладных междисциплинарных научных исследований, а также задачи подготовки специалистов, обладающих междисциплинарными компетенциями, требуют интенсивного развития и модернизации материально-технической базы» (Программа развития Московского университета, стр. 5;).
Кроме лазера в состав электронномеханического устройства входит также оптический фильтр, пропускающий луч лазера, но отражающий более длинноволновый свет на диафрагму, называемую «пинхолом» (от англ. Pinhole – проделанная булавкой дырка, дословный перевод отлично характеризует устройство пинхола), которая отсекает весь ненужный фоновый свет и тем самым снижает или вовсе сводит на нет влияние нижележащих оптических слоев на четкость отображения сканируемого участка клетки. Если бы фоновый свет не отсекался пинхолом, то оптические слои накладывались бы друг на друга и мешали наблюдателю – будто бы он смотрит сквозь листву вдаль. За диафрагмой располагается фотоприемник, оцифровывающий получаемую информацию.
Понятно, что такое «точечное» сканирование требует времени. Чтобы ускорить этот процесс в конфокальной системе используется еще один модуль, называемый спиннинг-диском, позволяющий за один акт работы лазера получить изображение не одной точки, а целой линии.
Патент на такую систему был получен в 1961 году профессором Массачусетского технологического института Марвином Минским. Активное ее использование началось в 80-х годах, а сейчас конфокальная микроскопия переживает свой расцвет. В России первый микроскоп появился в 2003 году, это был Axiovert 200M LSM510 Meta. За ним последовали другие, и теперь в нашей стране существует несколько крупных лабораторий, в числе которых и межкафедральная лаборатория на биологическом факультете МГУ. В распоряжении лаборатории пять микроскопов, в том числе: Olympus FV10i, Zeiss LSM710, Nicon Eclipse Ti-EAL.
Конфокальная микроскопия добилась не только высочайшего контраста и трехмерности, она освоила и четвертое измерение – время, позволив изучать изменения, происходящие в клетках. Для этих целей каждая установка снабжена системами поддержания их жизни. Все это дает широкие возможности для исследователей, которые этими возможностями с успехом пользуются.
И, раз уж речь идет о лаборатории биологического факультета МГУ, в качестве примеров следует упомянуть проведенные в этой лаборатории исследования.
Шелк и паутина
Конфокальная микроскопия добилась не только высочайшего контраста и трехмерности, она освоила и четвертое измерение – время, позволив изучать изменения, происходящие в клетках.
Одной из интересных работ является создание биодеградируемых протезов для восстановления сосудов и других полых органов. Такие тканеинженерные конструкции внешне представляют собой, в наиболее простых случаях, трубки или пленки, надевающиеся на место повреждения и выполняющие, таким образом, роль «заплатки». Их можно изготовить из разных материалов, в том числе из фиброина шелка коконов шелкопряда. Достоинство этого материала в том, что он стабилен и формирует гибкую и прочную структуру протеза. Сам протез выглядит как пленка только при рассмотрении невооруженным глазом, на самом деле он представляет собой матрикс — сетчатую многослойную основу, каркас, имитирующий строение живой ткани. Этот каркас помогает новым клеткам занять правильное положение, обеспечивая их равномерное распределение. В результате поврежденная стенка органа восстанавливается, а ставший ненужным каркас подвергается биодеградации. Но проверить, насколько равномерно распределяются по каркасу клетки, а также хорошо ли им живется в глубоких слоях матрикса (нет ли затруднений в газообмене и обмене продуктами метаболизма), и не изменяют ли они при проникновении внутрь него морфологии, не так-то просто. Именно на этом этапе применение микроскопа (Zeiss Axiovert 200M LSM 510) сильно упростило задачу. В основном за счет возможности исследовать объект без разрушения, а также за счет способности микроскопа смотреть внутрь матрикса на глубину до 600 мкм.
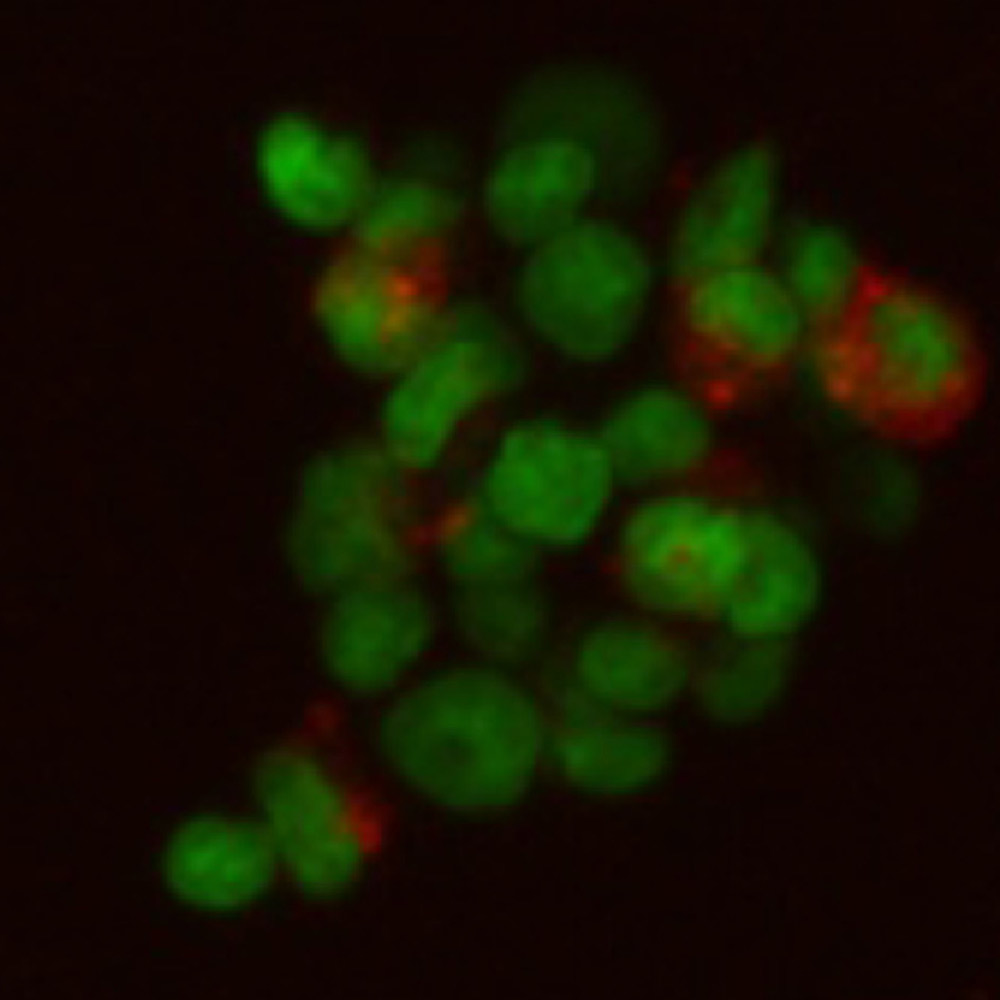
Фото: Фибробласты 3Т3 на стенках макропоры матрикса. Оптический срез в 50 мкм от поверхности матрицы. Матрикс выявлен TRITC (показан красным), ядра фибробластов выявлены SYTOX (показаны зеленым). Изображение получено с использованием микроскопа Axiovert 200M с конфокальной приставкой LSM510 META (с разрешения М.М.Мойсеновича).

Похожие работы были проведены и с костной тканью, матрикс для которой изготавливали как из того же фиброина, так и из спидроина — белка, изначально обнаруженного в организме паука и использующегося им для плетения паутины. В лабораторных условиях белок производят совсем не пауки, а дрожжи, в чей геном внедрен немного измененный ген паука, ответственный за синтез этого белка.
Не все так просто
Но, если возникновение повреждений в тканях – процесс простой и понятный, другие патологии понятны далеко не всегда. И прежде чем начать эффективное лечение и, тем более, предотвращение их развития, нужно выяснить механизм их возникновения. К числу таких относится атеросклероз — болезнь артерий, в результате которой в стенке сосуда, а точнее, в интиме – ее внутреннем слое, накапливаются липиды, делающие стенку толще, что в конечном итоге может привести даже к полной закупорке сосуда. Из-за чего возникает это заболевание, не совсем понятно, как и непонятно то, какую роль играют иммунокомпетентные клетки, в местах скопления которых вскоре начинается атерогенез. Полноценные ответы на эти вопросы еще не найдены, но изучение атерогенеза продолжается, хоть и публикаций на эту тему куда меньше, чем на тему тканеинженерных протезов.
Фото: Структура стенки поры матрицы из спидроина 1. Оптический срез на расстоянии 50 мкм от поверхности матрицы. (О.Л. Пустовалова, М.М. Мойсенович, П.С. Еремин, А.Ю. Архипова, А.А., Рамонова, О.С. Соколова, В.Г. Богуш, И.И. Агапов, М.П. Кирпичников. Культивирование клеток на трехмерной матрице из рекомбинантного спидроина 1. Российский иммунологический журнал, 3(2):139-146, 2009.)

Судьбы молекул
Межкафедральную лабораторию конфокальной микроскопии регулярно используют в своей работе более 20 студентов и аспирантов с почти 10 кафедр.
В описанных выше исследованиях в основном отслеживается состояние клеток. Но этим возможности конфокального микроскопа не ограничены, он вполне способен отследить даже судьбу отдельной молекулы в клетке – лишь бы она обладала флуоресцентной активностью. Для этого молекулы обычно метят флуорохромами – специальными красителями, имеющими эту активность. Флуорохромы существуют в виде отдельных молекул, и мечение ими заключается в химическом связывании флуорохрома с интересующей исследователя молекулой. После этого такие меченые молекулы попадают в клетку и их дальнейшую судьбу отслеживают при помощи микроскопа. Таким способом сравнивали, например, активность и перемещения в клетке рицина и вискумина. Оба вещества – белковые токсины, оба имеют растительное происхождение и состоят из двух частей – субъединиц, одна из которых ответственна за связывание с клеткой и проникновение внутрь, а другая – за инактивацию рибосомы, что в конечном итоге ведет к гибели клетки. Практическая польза опять же связана с лечением еще одного опасного заболевания – рака. Такое четкое «разделение обязанностей» между субъединицами позволяет заменить первую субъединицу, например, на антитело. Получится «иммунотоксин», действующий только на определенные клетки, к которым это антитело подойдет. Основных проблем две. Первая: выбор антитела, которое будет подходить к раковым клеткам и не допускать проникновения токсина в здоровые. И вторая: выбор токсина, который при превращении в иммунотоксин будет сохранять высокую эффективность.
Фото: Первичная культура клеток сердца новорожденных крысят: А — контроль, Б — обработанных 20мкМ изопротеренола в течении суток. 1 — окраска митохондрий TMRE; 2 — фазовый контраст. Шкала 10мкм. (Смирнова Т.А., Сапрунова В.Б. «Адаптационные изменения митохондрий культивируемых кардиомиоцитов новорожденных крысят под воздействием изопротеренола». Международная конференция «Рецепторы и внутриклеточная сигнализация» 24-26 МАЯ 2011г. Пущино).

Обучение
Список проведенных с использованием конфокальной микроскопии работ можно продолжать долго. Эффективный метод, к тому же позволяющий работать с живыми клетками, востребован практически в любом научном исследовании. И поэтому огромную роль играет подготовка студентов к работе в этой лаборатории. Регулярно ее посещают более 20 студентов и аспирантов, занимающихся курсовыми, предкурсовыми и дипломными работами.
Работают на установках эмбриологи, молекулярные биологи, цитологии, биоинженеры, иммунологи, зоологи.
Лаборатория конфокальной микроскопии основана в 2004 году.

Заведующий лабораторией – доцент М.М.Мойсенович


В лаборатории работают молодые специалисты А.А.Рамонова и А.Ю.Архипова
В настоящее время в лаборатории установлены 2 конфокальные системы:
- Axiovert 200M с конфокальной приставкой LSM510 META (Carl Zeiss, Германия)
- Конфокальная лазерная сканирующая система, производства «НИКОН КОРПОРЕЙШН» (Япония) — микроскоп медико-биологический инвертированный для лабораторных исследований Eclipse с принадлежностями: со штативом Ti-E, с TIRF-осветителем, с конфокальным модулем А1 и конфокальным модулем на основе спиннинг-диск.