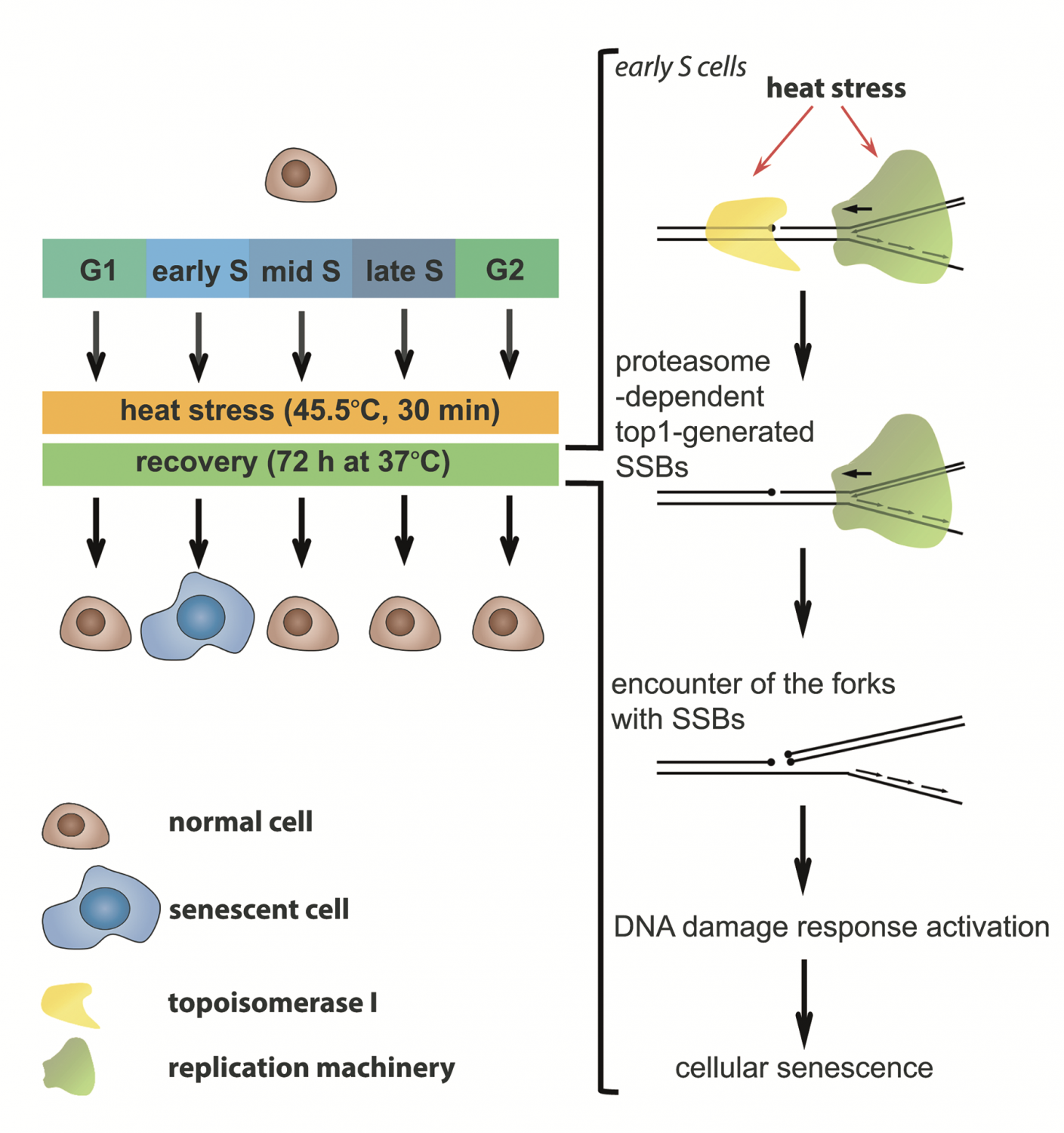
Тепловой шок (или стресс) — один из наиболее изученных факторов клеточного стресса, но о его отсроченных эффектах известно немного. Согласно двум статьям российских ученых (статья от 1 июня 2015 года в журнале Nucleic Acids Research была дополнена февральской статьей в журнале Cell Cycle), тепловой шок наиболее сильно сказывается на клетках, находящихся в ранней синтетической фазе, и вызывает не только кратковременную остановку удвоения ДНК, но и гораздо более тяжелые последствия. По словам одного из авторов работ Сергея Разина (заведующий кафедрой молекулярной биологии биологического факультета МГУ имени М.В.Ломоносова), результаты исследований помогут в развитии методов лечения онкологических заболеваний.
Когда клетка ломает вилки
Наши клетки, как и мы, тоже могут подвергаться воздействию шока и стресса, только, в отличие от нашего, вызывается он теплом, холодом, нехваткой кислорода, изменением кислотности среды, воспалением, инфекцией или токсинами,облучением рентгеном или ультрафиолетом.
«Мы показали, что острый тепловой стресс индуцирует клеточное старение в нормальных и раковых клетках человека, находящихся в ранней S-фазе клеточного цикла в момент воздействия. Мы идентифицировали механизм активации клеточного старения тепловым стрессом. Причиной индуцированного тепловым стрессом клеточного старения являются персистирующие (существующие постоянно) сигналы о повреждении ДНК, связанные с образованием сложнорепарируемых двухцепочечных разрывов ДНК», — сообщает Сергей Разин, заведующий кафедрой молекулярной биологии МГУ и заведующий лабораторией Института биологии гена РАН, доктор биологических наук и член-корреспондент РАН, соавтор обеих статей.
С помощью широкого набора методов (окрашивания флуоресцентными светящимися метками, вестерн-блот анализа и др.) российские ученые из МГУ имени М.В.Ломоносова и Института биологии гена РАН продемонстрировали, что клетка во время стресса способна «ломать» вилки. Но речь здесь идет не о металлических столовых приборах: вилками называются участки состоящей из двух цепей молекулы ДНК, где эти цепи разделены, чтобы к каждой из них могла достроиться еще одна (так происходит удвоение молекулы). Это достраивание происходит по принципу комплементарности, согласно которому каждому нуклеотиду — «букве» ДНК — соответствует парный ему, стоящий напротив.
Выяснилось, что тепловой шок подавляет действие топоизомеразы I, которая снимает напряженность молекулы ДНК, возникающую в процессе репликации, путем внесения одноцепочечного разрыва в ДНК. Это приводит к разрывам одной из цепей, а когда вилка репликации появляется в этом же месте, рвется и вторая цепь. Поскольку при починке таких разрывов специальные «ремонтные» белки ориентируются на аналогичный участок второй целой цепи, когда повреждены обе, молекула трудно поддается восстановлению.
Еще одним интересным результатом этой работы, по словам Сергея Разина, является «демонстрация того, что генетически идентичные клетки могут очень сильно отличаться как по степени устойчивости к разным экзогенным стрессовым факторам, так и по реакции на такие воздействия».
Подобно тому, как стресс по-разному влияет на человека в зависимости от участка жизненного пути, на котором он находится в данный момент, то, насколько клетка пострадает от жизненных неурядиц, также зависит от стадии клеточного цикла, на которой они ее застали. Поэтому имеет смысл поговорить о них подробнее.
Детство, отрочество, юность, митоз
Век каждой соматической (не половой) клетки нашего тела сильно варьируется в зависимости от ее особенностей: эритроциты (вогнутые с двух сторон красные клетки крови) живут около 120 дней, клетки эпителия, выстилающие изнутри кишечник — всего лишь 1-2 дня, а нейроны и поперечнополосатые мышечные клетки — столько же, сколько и сам организм. Короткоживущие клетки делятся постоянно, чтобы обеспечить себе достойную смену, «долгожители» — никогда или почти никогда.
При всем этом разнообразии у соматических клеток (не только нашего тела, но и остальных животных и растений) можно выделить 4 фазы клеточного цикла: G1, S, G2 (которые вместе составляют интерфазу) и фазу митоза (деления, в результате которого из одной материнской клетки образуются две совершенно одинаковые клетки-дочки, получившие в наследство по половинке-хроматиде от каждой материнской хромосомы). Во время фазы G1, пресинтетической, происходит рост клетки и подготовка к удвоению ДНК (репликации): получив половину от каждой хромосомы, клетка должна сама достроить вторую, чтобы передать ее уже следующему поколению. Само удвоение (синтез, отсюда и название — синтетическая фаза) происходит в S-фазе. За тем, чтобы генетическая информация не копировалась с ошибками, зорко следит белок p53: при повреждении ДНК он усиливает производство белка p21, который связывается с комплексом циклина и циклин-зависимых киназ, ответственных за начало следующих фаз клеточного цикла. Это откладывает старт S-фазы, чтобы репарационные ферменты успели устранить поломки. За S-фазой следует G2, во время которой клетка растет и готовится к предстоящему делению. На этой стадии ДНК снова проходит обязательный «техосмотр», и после этого переходит к митозу. За митозом у каждой из «новорожденных» клеток опять наступает фаза G1, и цикл повторяется.
Вырваться из колеса сансары
Некоторые клетки покидают череду делений, надолго замирая в фазе G0 (которая выделяется в пределах фазы G1). Но и для остальных клеточный «круговорот перерождений» не бесконечен: примерно после 52 делений (так называемый предел Хейфлика, названный в честь ученого Леонарда Хейфлика, открывшего его в 1961 году) клетка стареет, становясь безучастной к мирской суете — выходит из своего «колеса сансары» и прекращает митоз, а через некоторое время погибает. Но когда ДНК в клетке повреждается настолько, что ее трудно починить, проще вывести клетку из цикла раньше, чтобы не копировать поврежденный генетический код, снова и снова создавая поколения мутантов, что в масштабах организма приводит к воспалению и раковым опухолям.
«На основании исследования реакции клеток на тепловой стресс мы сформулировали модель индукции клеточного старения, которая верна для многих повреждающих ДНК агентов. Согласно этой модели, практически любое повреждение ДНК (одно- или двухцепочечный разрыв), произошедшее в ранней S-фазе клеточного цикла, может привести к запуску программы клеточного старения», — рассказывает Сергей Разин.
Значение исследований в этой области двояко. С одной стороны, ученые стремятся предотвратить старение здоровых клеток: помочь им защититься от стресса и не выходить из строя как можно дольше (конечно, в рамках, определенных их функциями). С другой стороны, запуск клеточного старения помогает «слетевшим с катушек генетической программы» бешено делящимся раковым клеткам найти путь к собственной «нирване». Поэтому при терапии онкологических заболеваний важно найти ту «бритву Оккама», что заставит клетки с дефектным геномом прекратить делиться и плодить лишние сущности.
«Раскрытие механизмов индуцированного слабым генотоксическим (повреждающим ДНК) стрессом клеточного старения представляется важным как для понимания причин и механизмов старения организма в целом, так и для лучшего понимания вариативности клеточного ответа на экзогенные и эндогенные стресс-факторы. Эта работа также проливает свет на возможные неисследованные ранее эффекты различных повреждающих ДНК агентов (например, камптотецина), которые часто используются в химиотерапии опухолей. Теоретически, результаты этой работы могут составить основу для оптимизации существующих протоколов одновременного применения гипертермии и химиотерапевтических агентов для лечения онкологических заболеваний», — заключает Сергей Разин.
Источник: https://www.msu.ru/