Фото 1. Cлева направо: к.ф.-м.н., н.с. В.А. Федоров, м.н.с. Е.Г. Холина, д.ф.-м.н., в.н.с. И.Б. Коваленко (кафедра биофизики биологического факультета МГУ); к.ф.-м.н., с.н.с. Н.Б. Гудимчук (кафедра биофизики физического факультета МГУ).
Исследование может пролить свет на патофизиологию нейродегенеративных заболеваний, его результаты опубликованы в высокорейтинговом научном журнале Developmental Cell.
Внутренний скелет клеток высших организмов состоит из трех основных типов белковых структур: микротрубочек, актиновых нитей и промежуточных филаментов. Наиболее жесткими каркасными структурами являются микротрубочки, представляющие собой длинные цилиндры, собранные из двух похожих глобулярных белков: α- и β-тубулинов.
С помощью микротрубочек осуществляются многие жизненно важные процессы: движение клеток с помощью жгутиков и ресничек, внутриклеточный транспорт, поддержание формы клеток, организация внутриклеточного пространства и клеточное деление. В основе многофункциональности микротрубочек лежит явление динамической нестабильности. То есть микротрубочки могут спонтанно переходить от медленного удлинения к стремительному укорочению.
Во всех клетках организма сборка и разборка микротрубочек четко регулируется. Например, в одних тканях они становятся более стабильными, а в других — динамика полимеров тубулина наоборот активизируется, приводя к изменению микротрубочек. Более того, иногда эти процессы настраиваются по-разному в разных частях одной клетки. Для этого специальные ферменты помечают гибкие участки на концах тубулинов — тубулиновые хвосты — с помощью специальных модификаций. Ферменты могут, например, отсоединить аминокислоты от тубулинового хвоста или, наоборот, подшить их. Поскольку подобные модификации сообщают информацию о дальнейших перестроениях, их называют тубулиновым кодом.
О том, к каким изменениям приводят те или иные модификации, на сегодняшний день известно довольно много. А вот как именно это информация считывается и реализуется до сих пор не ясно. Исследователи из России и США решили выяснить один из аспектов этого вопроса — модификации тубулиновых хвостов сами по себе приводят к изменению динамических свойств микротрубочек, или они служат лишь сигнальным агентом для других белков.
Сотрудники кафедр биофизики биологического и физического факультетов МГУ имени М.В. Ломоносова теоретически показали, что тубулиновые хвосты могут напрямую влиять на скорость сборки микротрубочек. «На суперкомпьютере “Ломоносов-2” мы провели молекулярно-динамические расчеты, которые позволили теоретически показать, что гибкие хвосты α-тубулинов могут блокировать поверхность глобулы тубулина, необходимую для встраивания субъединицы тубулина в микротрубочку», — рассказывает ведущий научный сотрудник биологического факультета МГУ Илья Борисович Коваленко.
Американская часть научного коллектива экспериментально проверила теоретические предсказания учёных МГУ. Опыты показали, что удаление гибкого хвоста α-тубулинов почти вдвое ускоряет сборку микротрубочек. Это позволяет предположить, что белки, связывающиеся с тубулинами, способны активировать сборку микротрубочек, взаимодействуя с заряженным хвостом тубулина. В статье также впервые показано, что удаление аминокислоты тирозина с конца заряженного хвоста α-тубулина влияет на микротрубочки опосредованно, препятствуя посадке на микротрубочки дополнительных регуляторных белков.
«Совокупно полученные нами данные проясняют механизмы изменения динамики микротрубочек, зашифрованные тубулиновым кодом. Понимание тонкой регуляции свойств микротрубочек с помощью их гибких хвостов может пролить свет на патофизиологию нейродегенеративных заболеваний и нарушений развития организма, связанных с отклонениями динамических свойств микротрубочек от нормы», — заключает руководитель теоретической части работы, старший научный сотрудник физического факультета, Никита Гудимчук, автор-корреспондент публикации.
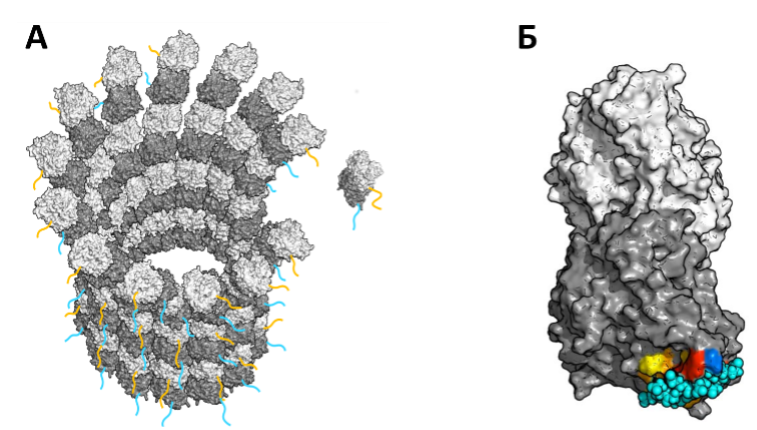
Рисунок 1 Иллюстрация роли хвостов тубулинов в регуляции их сборки. A. Конец микротрубочки и присоединяющийся димер тубулина. β-тубулины показаны светло-серым, α-тубулины – темно- серым цветом, а их гибкие хвосты – оранжевым и бирюзовым, соответственно. Б. Крупный вид димера тубулина с α-хвостом, блокирующим поверхность взаимодействия с микротрубочкой. Красным и желтыми цветами отмечены участки глобулярной поверхности, с которыми наиболее часто взаимодействует заряженный хвост тубулина. Синим показана аминокислота в основании хвоста // Источник: Chen J. et al. α-tubulin tail modifications regulate microtubule stability through selective effector recruitment, not changes in intrinsic polymer dynamics // Developmental Cell. – 2021.